年代測定で使われる炭素14年代測定法をわかりやすく解説!!
考古学の世界では、文化的遺産や化石などの年代を測定するのに炭素14年代測定という方法があります。
縄文時代の記事を書いた時にも炭素14年代測定法のキーワードが出てきたました。
そこで今回は炭素14年代測定法について少し詳しく書いていきます。
炭素14年代測定法とは?
ちなみにWikipediaでは…
自然の生物圏内において放射性同位体である炭素14 (14C) の存在比率が1兆個につき1個のレベルと一定であることを基にした年代測定方法である
と書かれていますが、何のことやらサッパリです。
この小さな化石はいつのモノ?
と放射性炭素年代測定法で調べると【おそらく○○年前のモノ】と言った具合に測定できます。これまでは、このおそらくが、21000年前までしかさかのぼれなかったのですが、新たに発表された研究成果によると、従来用いられてきた木の年輪やサンゴ、微化石などの年代データを使い、2万6000年前までの正確な測定を行なうことが可能になりました。
炭素元素の同位体
化学の話にりますが、原子には同位体と言うものが存在します。
同位体とは…
『同じ原子番号を持つ元素の原子において、原子核の中性子(つまりその原子の質量数)が異なる核種の関係、あるいは核種』
wikipediaより
の事で、中学校や高校で習った様な気がしますが、もう何十年も前の話なのですっかり忘れているのは私だけではないはず。
元素には原子の中に含まれる中性子の数により同位体があることは学校で習いました。
メディアでよく目にするのはウラン元素で、ウラン235やウラン238というのをよく耳にします。
これと同様に炭素にも同位体があり、自然界に存在する炭素の同位体には、炭素12、炭素13、炭素14があります。
それぞれ中性子の数が6個、7個、8個になっています。
炭素12と炭素13は放射性がなく安定しているので、崩壊する(他の元素に変わる)ことはありません。炭素14は放射性原子で、放射線を放つことで別の物質(原子)に変わり、炭素ではなくなってしまいます。
原子とは?
元素の最小単位で、物質を分けた時にこれ以上分けられないとこまでの小さな粒の事を言います。その原子はプラスの電荷をもつ陽子と電荷を持たない中性子を合わせた原子核、さらにプラスの電荷に引き寄せられたマイナスの電荷をもつ電子で成り立っています。
ちなみに、陽子の数と電子の数は常に等しい。
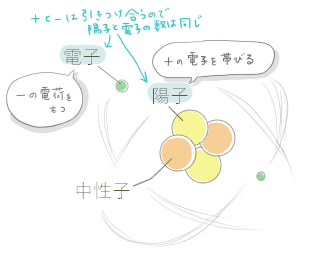
この図はヘリウム原子の模式図ですが、オレンジと黄色の円がそれぞれ陽子と中性子、黄緑が電子であることを表しています。
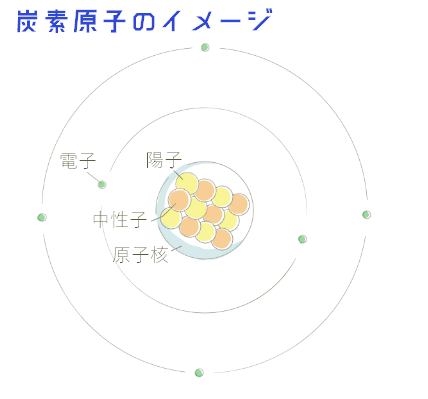
基本的にはオレンジと黄色がそれぞれ6つずつ集まっているのが炭素となります。
炭素14について
炭素は原子番号が6の元素で、6つの陽子と6つの中性子で構成されているのが基準です。ところが時々、中性子の数が違っている場合があります。
炭素を構成している中性子(上の図だとオレンジの円)が7つの時には炭素13(C13)、8つの時は炭素14(C14)と言われ、炭素の「同位体」として自然界に存在しており、この「13」とか「14」は質量数(重さ)を指しています。
その同位体の中には構造が不安定で時間と共に放射性崩壊(α線、β線、γ線という放射線を出すことで安定的な原子核に変化すること)を起こす放射性同位体と呼ばれるものがあり、炭素14はその一つ。炭素の同位体としては天然で見られる唯一のもので、半減期は放射性同位体としては長寿命の5730年もあります。
この炭素14は、空気中に一番多く存在する窒素が成層圏で宇宙空間にある高エネルギーを持つ宇宙線(原子核や素粒子などの粒子で構成)に反応して常時新たに再生され、地上に降りてくることで存在しています。なお、自然界の炭素の割合はC12(存在比98.93%)、C13(存在比1.07%)、C14(微量)で、自然界でその割合は一定を保っているそうです。1万年前に作られた炭素14も当然存在します。
最終的には、炭素14は窒素に変わり、同位元素はエネルギー(放射線)を出しながら徐々に安定な状態に変わっていき、やがてエネルギー(放射線)を出さない安定した原子に落ち着きます。
このような、放射線を出して他の原子に変わる能力のことを放射能と呼ばれ、これはキュリー夫人が名付けました。半減期は、種類によってことなり短いものでは1秒以下、長いものだと何億年と言うものもあります。
炭素14年代測定法について
炭素14年代測定法とは、炭素14と呼ばれる放射性物質に注目した年代測定法です。
世の中にできているすべての物は、原子で出来ています。
もちろん私たち生物も原子から成り立っています。
通常、大部分の原子は安定した状態を保っていますが、一部の原子は不安定な状態になる事もあり余分なエネルギーを外に出して安定した原子に変化しようとします。
この時に出るエネルギーを放射線と呼び、その放射線を出す物質を放射線物質といいます。
この炭素14は、大昔から大気中に一定の割合で含まれています。
動植物たちは、呼吸したり食物を摂取する事によって大気中の炭素14を取り込んでいます。そのため、命が失うと炭素14の供給が無くなり体内に残った炭素14は放射線を出して減っていきます。
その量が半分になるのが【半減期】と呼ばれ、5730年かかります。
だから、炭素14の割合と動植物の体内に残っている炭素14の割合を調べると発掘された土器に付いた穀物や動物の歯や化石の年代が分かります。
例をあげると縄文時代に作られたであろう竪穴式住居の木片が見つかったとします。
当然そこで使用された木材は、そのころ生えていた木を使ったと推測されます。その木は、その当時の大気中の二酸化炭素を吸収し成長しました。仮に木に10個の炭素14が含まれていたとすると、その木が切られてしまうとこれ以上炭素を取り込まなくなります。
ここからスタートします。
そして、現代になり発掘された木の炭素14が当時の半分【5個】になっていれば、その木が生きていた頃は約5700年前だったことが示されます。つまりこの竪穴式住居がある遺跡は、5700年前の判断できるわけです。
炭素14が7個であれば2500年前、2個であれば1万年前と言うわけです。
炭素14年代測定法では10万年位しか測定できない!?
先ほど炭素14の半減期は5730年と書きましたが、これを繰り返すと少なくなっていくのですが、限界はあるのでしょうか?
半減期を繰り返すとやがてこれ以上測れないくらいの小さな値【測定限界】に達します。
これを計算で表すと…
半減期を
- 2回繰り返すと、元の量の1/4(2の2乗)
- 4回繰り返すと、元の量の1/16(2の4乗)
- 8回繰り返すと、元の量の1/256(2の8乗)
半減期を10回繰り返すと測定限界を超え1/1024になります。実際に2を10回掛けて見て下さい。
よって炭素14は、半減期の5730年を10回繰り返すと5730×10=57300年が測定の限界を超えてしまうため理論上は6万年前までしか測定できないのです。
だから、3~4億年前のアンモナイトの化石を測定しても炭素14は検出されないと言う事になります。実際に検出されたらそれは、異物の混入を疑われることになります。
以上事から、年代測定法は様々な仮定のに計算された数字で、炭素14事態の半減期事態も仮定の数字です。機械を使って測定はしているのですが、あくまでも仮定での話なので実際は【推定】していると言う事になります。
また、炭素法は動植物などの生体にしか利用できず、動植物以外の岩石や鉱物の年代を測定するには、ウラン-鉛法やカリウム-アルゴン法などがあります。しかし、これらの測定法にも、炭素法同様、前提条件があるようです。






